Numero 8 di Lettere di Ortobiologia
MICROASPIRATO MIDOLLARE AUTOLOGO
Caratterizzazione e utilizzi in ortopedia
INTRODUZIONE
Le principali organizzazioni mondiali sanitarie, come l’OMS, confermano che le malattie muscoloscheletriche, in particolare l’osteoartrosi (OA), sono la principale causa di disabilità globale (Purita et al. 2020; Lana et al. 2020-2021; Kuebler et al. 2022). Esse colpiscono sia la popolazione giovane che quella anziana mettendo a rischio ossa, tessuti, articolazioni e strutture muscolari e generando un impatto socioeconomico e psicosociale dannoso (Lana et al. 2020-2021; Woodell-May et al. 2021).
Attualmente le tipologie di trattamento si suddividono in approccio non farmacologico, in cui i principali trattamenti impiegati sono fisioterapia, rieducazione, esercizio fisico tutori e trattamenti chirurgici di protesizzazione e farmacologico, che mira alla sedazione della sintomatologia dolorosa, senza però risolverne la causa. Dati i gravi effetti collaterali osservati in seguito all’utilizzo di FANS si è cercato un approccio diverso, da cui è nata la medicina rigenerativa, portando allo sviluppo dell’ortobiologia (Purita et al. 2020; Lana et al. 2020-2021; Kuebler et al. 2022).
L’ortobiologia riguarda tutti quei prodotti chiamati autologhi perché vengono prelevati dal paziente stesso e riutilizzati nella medesima seduta chirurgica o ambulatoriale per promuovere la rigenerazione dei tessuti danneggiati dal trauma o prevenire la degenerazione tissutale causata da una patologia. I principali utilizzati nel campo dell’ortopedia sono il PRP, il tessuto adiposo e l’aspirato/concentrato midollare (BMA/BMAC), di cui parleremo in questo articolo (Purita et al. 2020; Lana et al. 2020-2021; Kruel et al. 2021; Zaffagnini et al. 2022; Kuebler et al. 2022).
I principali vantaggi dell’ortobiologia sono: la mini-invasività delle procedure, l’elevato potenziale di guarigione, tempi brevi di ricovero ospedaliero e ridotti costi rispetto alla chirurgia ordinaria (Kruel et al. 2021; Zaffagnini et al. 2022).
In particolare, è stato osservato che i meccanismi rigenerativi legati al coagulo di BMA sono molto simili agli ematomi da frattura, cioè i processi che guidano e promuovono il rimodellamento osseo e la guarigione della frattura (Lana et al. 2021).
MIDOLLO OSSEO
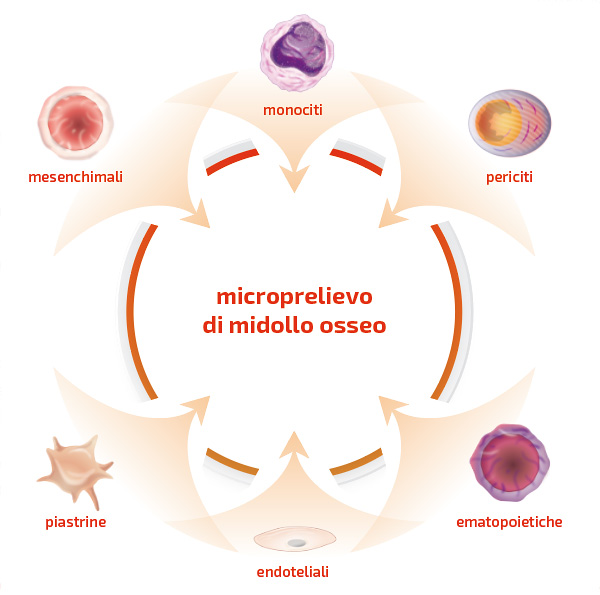
Il midollo osseo è un tessuto situato nelle cavità centrali delle ossa assiali e lunghe ed è una fonte di cellule progenitrici e staminali adulte. Le popolazioni cellulari presenti sono molteplici e possono essere suddivise in non ematopoietiche (periciti, cellule endoteliali, osteoblasti, adipociti, cellule di Schwann), ematopoietiche (neutrofili, linfociti, megacariociti, monociti, osteoclasti), funzione angiogenetica/vasculogenetica (EPCs), staminali adulte (ematopoietiche e mesenchimali) e piastrine (PLTs) (Cotter et al. 2018; Schäfer et al. 2019; Harrell et al. 2015; Gianakos et al. 2017; Imam et al. 2017; Purita et al. 2020; Lana et al. 2021; Lucas et al. 2021; Woodell-May et al. 2021).
Le staminali adulte ematopoietiche (HSCs) sono cellule adulte multipotenti, capaci di produrre progenitori che possono differenziarsi unicamente nelle cellule del sangue e del sistema immunitario; sono presenti in bassissime concentrazioni nel midollo osseo (1:10.000) (Hernigou et al. 2005). Oltre alle HSCs il midollo osseo è composto dallo stroma, in cui sono presenti i precursori osteogenici, con nota capacità di supporto alla riparazione tissutale in senso osteogenico. Molti utilizzano il midollo osseo per questa sua capacità osteogenica, come rinforzo ad allograft e xenograft nella chirurgia ricostruttiva o riparativa (Hernigou et al. 2005).
Le cellule mesenchimali (MSCs) sono l’altra famiglia di staminali adulte, chiamate multipotenti, per la loro capacità di differenziarsi nelle sole linee cellulari connettivali a seconda dell’ambiente in cui si trovano e degli stimoli a cui vengono sottoposte. Il processo di azione delle MSCs è guidato dai fattori di crescita (VEGF, IGF-I, TGF-β, PDGF-BB, IL-1b etc.) che hanno funzione regolatoria, di reclutamento cellulare e di promozione del processo di neoangiogenesi. Inoltre, queste cellule, mediante la loro attività paracrina e autocrina, rilasciano un elevato numero di fattori, influenzando la locale risposta di guarigione dei tessuti: riducono l’apoptosi cellulare, la fibrosi cellulare e l’infiammazione, attivano la proliferazione, la mobilizzazione, la differenziazione cellulare e l’angiogenesi (Imam et al. 2017; Madry et al. 2017; Caplan & Dennia 2006; Purita et al. 2020; Lana et al. 2021; Zaffagnini et al. 2022; Pasculli et al. 2022). Le MSCs hanno dunque un ruolo importante nella riparazione e rigenerazione di molti tessuti in ambito ortopedico (Cotter et al. 2018; Imam et al. 2017; Madry et al. 2017; Day et al. 2023; Smith et al. 2023).
Il midollo osseo ospita una famiglia eterogenea di popolazioni cellulari e un ricco secretoma. L’utilizzo di midollo osseo aspirato (BMA) è considerato un approccio sicuro e praticabile, indicato per il potenziamento dei meccanismi di riparazione tissutale, modulando l’infiammazione e fungendo da impalcatura biologica naturale nonché da serbatoio di citochine e fattori di crescita che supportano l’attività cellulare (Lana et al. 2021; Pasculli et al. 2022; Kuebler et al. 2022).
Nel midollo osseo, le MSCs sono una piccola percentuale delle cellule nucleate presenti (0.001-0.01%) per cui è fondamentale la tecnica di prelievo per riuscire a raccogliere la massima cellularità, senza diluizione con il sangue periferico circostante, garantendo allo stesso tempo la procedura meno invasiva, a minore morbilità del sito e senza manipolazione (Hernigou et al. 2005).
ASPIRATO MIDOLLARE AUTOLOGO
Il midollo osseo aspirato (BMA) è fonte di componenti cellulari utili alla riparazione delle lesioni cartilaginee, ossee e dei tessuti molli e viene generalmente raccomandato per il trattamento di osteoartrosi, difetti ossei e cartilaginei, rotture di legamenti, osteonecrosi della testa del femore, ritardi di consolidamento e pseudoartrosi (Lana et al. 2021; Viganò et al. 2022; Zaffagnini et al. 2022; Kuebler et al. 2022).
L’uso omologo dell’aspirato midollare autologo è garantito dalla sua preparazione nel medesimo tempo chirurgico, dal fatto che viene aspirato dallo stesso sito in cui viene fatto il prelievo di spongiosa da cresta iliaca, dal mantenimento della funzione del sito donatore nel sito ricevente e dall’assenza di manipolazione.
Viene utilizzato tale quale viene prelevato ed è quindi fondamentale la tecnica di prelievo per avere un aspirato ricco di cellule e non diluito con il sangue periferico. Allo stesso modo, infatti, il prelievo di spongiosa da cresta iliaca (gold standard secondo le linee guida) non viene utilizzato per la sua funzione ematopoietica ma per le capacità di aumentare e velocizzare la rigenerazione ossea, mediante le attività paracrine e autocrine delle cellule midollari presenti nella spongiosa dell’innesto. Il BMA autologo permette di ottenere gli stessi vantaggi di un prelievo di spongiosa, senza la morbilità di un trattamento invasivo e le possibili conseguenze che ne derivano quali: fratture, difficoltà di rideposizione ossea, tempi di guarigione molto lunghi, post operatorio molto doloroso. In particolare, è stato dimostrato che in presenza di condizioni infiammatorie i condrociti umani aumentano l’espressione delle metalloproteasi cataboliche 1 e 3, che vanno ad acuire la patologia degenerativa in atto. L’utilizzo di BMA contrasta questa risposta catabolica allo stimolo infiammatorio, riducendo l’espressione di queste metalloproteasi (Viganò et al. 2022).
Il sito migliore per l’aspirazione del midollo osseo è la cresta iliaca, che contiene una concentrazione cellulare media decisamente maggiore di progenitori osteoblastici, rispetto a tibia, calcagno e femore (Cotter et al. 2018; Imam et al. 2017; Hernigou et al. 2013; Salamanna et al. 2017; Kruel et al. 2021; Lana et al. 2021).
Il corretto posizionamento del trocar è essenziale per una buona raccolta di midollo osseo. Herniugou et al. (2013) chiariscono che il trocar deve essere posizionato nel settore 2 o 3 dell’ala iliaca anteriore superiore: in quest’area si ottiene un buon volume di aspirato midollare con una buona raccolta cellulare. La tecnica di aspirazione incide notevolmente sul numero di cellule progenitrici che vengono raccolte. È stato dimostrato che prelevare piccoli volumi da diverse regioni subcorticali produce una resa migliore in quanto a concentrazione di cellule progenitrici (Lana et al. 2021). L’aspirazione di grandi volumi, invece, provoca una diminuzione nella concentrazione delle cellule progenitrici a causa della diluizione del midollo osseo con il sangue periferico (Salamanna et al. 2017; Kruel et al. 2021; Kuebler et al. 2022). Inoltre, Hernigou et al. (2013) hanno notato che un aspirato di 5 ml effettuato con siringa da 10 ml contiene il 300% in più di MSCs e cellule progenitrici rispetto ad un aspirato fatto con una siringa da 50 ml.
A fronte di tutte le considerazioni in merito al sito di prelievo si è visto che la cresta iliaca resta il sito principale per una maggior ricchezza in MSCs e cellule progenitrici, in particolare la cresta posteriore (Kruel et al. 2021).
Inoltre, la maggior parte delle MSCs si trovano nella regione subcorticale, mentre i periciti attorno ai vasi sanguigni, quindi effettuare prelievi ad una profondità troppo elevata potrebbe inficiare la raccolta di tali cellule (Lana et al. 2021).
Per alcuni trattamenti è preferibile non utilizzare anticoagulante in modo tale che il midollo, subito dopo l’aspirazione coaguli e formi un clot. I coaguli di BMA sono formati da una fitta rete di fibrina che facilita la diffusione di nutrienti e la differenziazione delle MSCs verso il lineaggio osteogenico, incoraggiando il rilascio dei fattori di crescita, l’integrazione e la guarigione dei tessuti (Salamanna et al. 2017; Lana et al. 2021). Per queste ragioni è incoraggiante l’utilizzo di clot di BMA anche per le riparazioni focali condrali in quanto favorisce e accelera la riparazione cartilaginea (Salamanna et al. 2021).
RECOVERYCELL
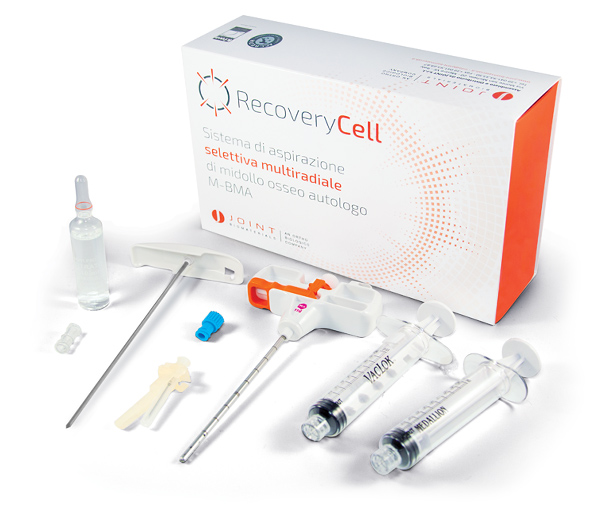
RECOVERYCELL è un kit sterile monouso dedicato alla produzione di microaspirato midollare autologo. Contiene tutte le componenti necessarie alla procedura in confezione singola sterile.
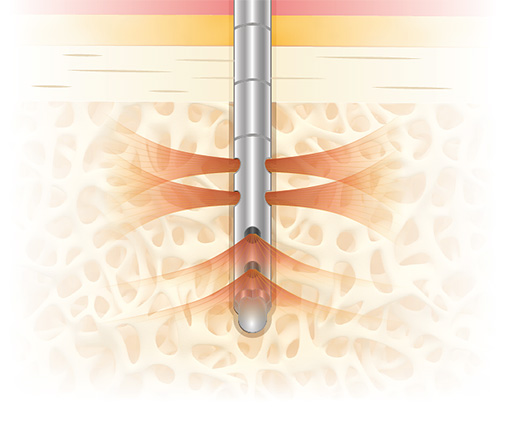
RECOVERYCELL è un prodotto unico poiché dotato di un trocar brevettato con cannula di aspirazione a punta terminale chiusa in modo tale da aspirare con pressione maggiore solo dai piccoli fori laterali. I fori di aspirazione sono disposti a spirale per una lunghezza di 2,5 cm.
Il brevetto del trocar è costituito da un meccanismo a “cassetto” chiamato sliding-block che permette di aprire i fori laterali in maniera alternata, due piani per volta, per poter effettuare le microaspirazioni di midollo osseo su 4 diversi piani a 360° senza dover cambiare inclinazione o posizionamento del trocar.
Grazie allo sliding-block la cannula di aspirazione viene allineata inizialmente con i fori esterni del trocar corrispondenti al primo e terzo livello, permettendo la prima microaspirazione; la seconda microaspirazione viene effettuata agendo sullo sliding-block, che permette di retrarre la cannula di aspirazione senza spostare il trocar, riallineandola con i fori del secondo e quarto livello. In questo modo si ottengono due microaspirazioni da 4 diversi livelli all’interno della cresta iliaca del paziente, per un totale di 5 ml.
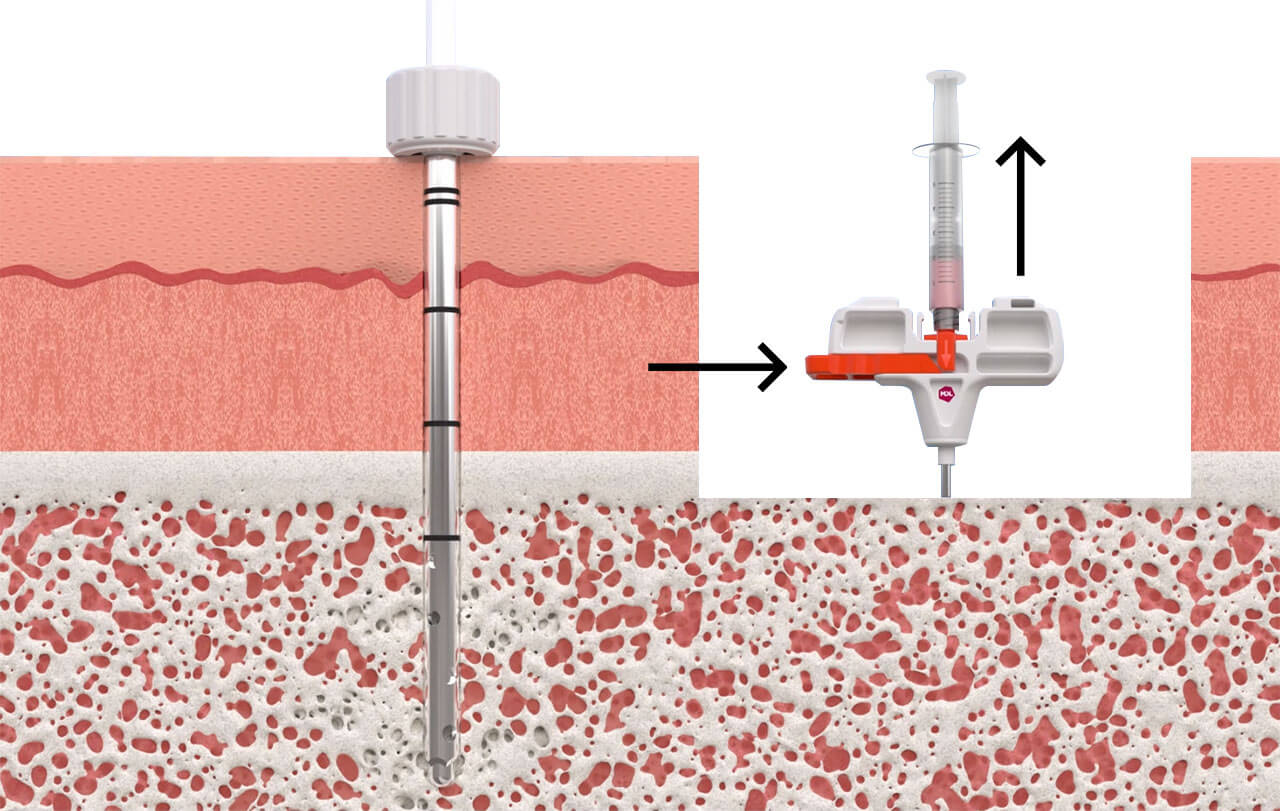
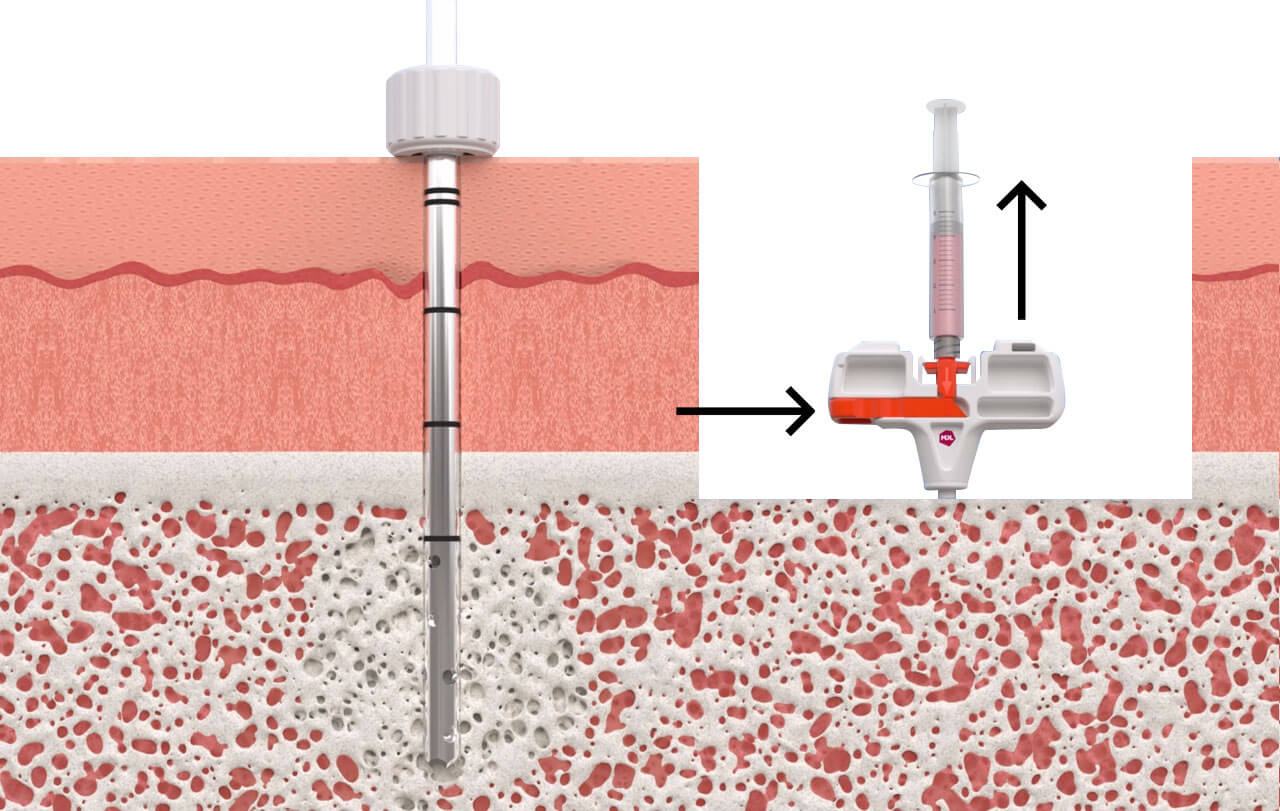
Nel kit è presente anche una fiala di sodio citrato al 3.8% che può essere utilizzata come anticoagulante nel caso in cui il BMA debba essere mantenuto liquido; può non essere utilizzato e il midollo può essere aspirato e lasciato clottare in siringa o in una ciotolina sterile.
Tutte le componenti del kit sono in confezione singola sterile, proprio per permettere di aprirle man mano che devono essere utilizzate con lo scopo di preservare nel miglior modo possibile la sterilità. Il kit contiene: il trocar brevettato, due siringhe da 10 ml, un ago ipodermico da 19 G, un tappo sterile e la fiala di sodio citrato al 3,8%.
Il volume per ciascuna delle due aspirazioni è stato fissato a 2/3 ml massimo, per un totale di massimo 5 ml, come riportato in letteratura. Gli studi hanno stabilito infatti che, in assenza di manipolazione o centrifugazione, per assicurare una buona raccolta cellulare le aspirazioni di midollo osseo devono avere un volume totale massimo pari a 5 ml. Inoltre, più è piccola la siringa e più i fori di aspirazione avranno un diametro ridotto più pressione saranno in grado di esercitare e quindi di staccare le cellule nucleate dalle trabecole ossee.
Una prima caratterizzazione dell’aspirato ottenuto con RECOVERYCELL è stata eseguita dalla Dott.ssa Mazzucco, Responsabile del Laboratorio di Produzione di Emocomponenti e Medicina Rigenerativa del Centro Trasfusionale dell’Azienda Ospedaliera SS Antonio e Biagio e Cesare Arrigo di Alessandria. Tale analisi ha evidenziato che è avvenuta una buona raccolta di precursori staminali mesenchimali, senza che si rendano necessarie ulteriori lavorazioni. Sistemi che effettuano grandi volumi di prelievo non riescono a concentrare le cellule progenitrici nell’aspirato, poiché nel sangue periferico sono contenute pochissime cellule staminali/progenitrici e per ottenere una buona concentrazione di progenitrici hanno bisogno di una minima manipolazione: la centrifugazione.
I vantaggi del microprelievo one step sono: la velocità e la semplicità di esecuzione della procedura, senza uscire dal campo sterile, minimizzando possibili contaminazioni e limitando il numero di passaggi; la disponibilità di una piccola quantità di volume (5 ml) anche per procedure mininvasive; l’esecuzione del prelievo attraverso un singolo sito di ingresso che riduce notevolmente la morbilità nel paziente; l’approvvigionamento di BMA, non statico ma variabile in un raggio circoscritto con minimo richiamo di sangue periferico.
RECOVERYCELL permette una rapida ed efficace raccolta cellulare senza la necessità di ulteriori manipolazioni, grazie alla conformazione del trocar brevettato.
RECOVERYCELL è regolarmente registrato al Ministero della Salute e viene assemblato da Joint Srl, azienda certificata ISO 13485 per l’assemblaggio di kit sterili.
INDICAZIONI D’USO
Le indicazioni d’uso per il midollo osseo aspirato (BMA) autologo sono molteplici secondo vari studi effettuati negli ultimi 20 anni. In particolare coinvolgono tutte quelle patologie degenerative e non ed eventi traumatici a carico di articolazioni, ossa e cartilagine. Fino ad ora l’approccio farmacologico è sempre stato il principale ma a fronte di numerosi effetti avversi e varie sensibilizzazioni l’approccio ortobiologico si sta diffondendo sempre di più con risultati migliorativi nel breve-medio periodo e di mantenimento nel lungo periodo.
Con l’ortobiologia e in particolare con il midollo osseo si possono trattare: OA di anca (I e II grado) e di ginocchio (I-III grado), necrosi avascolare dell’anca, edema midollare e sofferenza dell’osso subcondrale, ritardi di consolidamento, pseudoartrosi e lesioni cartilaginee (Hernigou et al. 2005; Viganò et al. 2022; Zaffagnini et al. 2022; Kuebler et al. 2022; Pasculli et al. 2022; Day et al. 2023).
Le patologie dell’anca si dividono in: intrarticolare, periarticolare e intraossea. Tutte le patologie legate a questi 3 comparti possono essere efficacemente trattati con l’ortobiologia per le loro caratteristiche biochimiche e biologiche (Kruel et al. 2021; Kuebler et al. 2022; Pasculli et al. 2022; Day et al. 2023). La necrosi avascolare e l’OA dell’anca vengono trattate specificamente con l’ortobiologia, con risultati duraturi (Kruel et al. 2021).
In particolare, l’ortobiologia sta guadagnando sempre più interesse come opzione per il trattamento mini-invasivo dell’osteoartrosi (OA) di grado I-III K-L per ridurre la sintomatologia, migliorare la funzionalità articolare, prevenire la progressione della patologia e in caso ritardare la necessità di un intervento di protesizzazione. Spesso il trattamento per l’OA viene effettuato mediante iniezione intrarticolare, utilizzando soprattutto il midollo osseo, proprio per la presenza di MSCs e piastrine (Woodell-May et al. 2021; Zaffagnini et al. 2022; Pintore et al. 2023).
Per un trattamento efficace dell’OA di ginocchio, Viganò et al. (2022) e Silva et al. (2022) propongono una tecnica di iniezione di midollo osseo aspirato sia a livello di osso subcondrale sia intrarticolare. Le iniezioni a livello subcondrale vengono effettuate mediante lo stesso trocar utilizzato per il prelievo del BMA, posizionato correttamente con l’ausilio della scopia. In alcuni casi la procedura viene effettuata dopo l’artroscopia.
Le lesioni a carico del midollo osseo, spesso chiamate edema midollare dell’osso subcondrale, possono essere efficacemente trattate con il BMA, sia per migliorare l’ambiente osseo e rimodellare la spongiosa, sia per migliorare lo stato artrosico dell’articolazione, prevenendone un peggioramento. L’iniezione diretta di BMA a livello di osso subcondrale infatti permette di agire sia sulla spongiosa dell’osso subcondrale, sia sulla cartilagine articolare, che riflette le condizioni dell’osso subcondrale, andando a limitarne la degenerazione e l’infiammazione articolare (Pasculli et al. 2022).
Anche in caso di pseudoartrosi o ritardi di consolidamento il BMA si è dimostrato utile nel ridurre i tempi di consolidamento della frattura e aumentare il successo. L’aspirato midollare è da preferire rispetto all’autotrapianto di spongiosa da cresta iliaca perché la sopravvivenza cellulare nel trapianto di spongiosa è inferiore (Hernigou et al. 2005). Nel caso specifico di ritardi di consolidamento il BMA iniettato per via percutanea è un metodo valido ed efficace per promuovere la formazione di callo osseo seguendo un trattamento mininvasivo. Per questo tipo di approccio il gap osseo deve essere minimo e non richiedere innesti di tessuto osseo (Hernigou et al. 2005).
In uno studio effettuato nel 2017 da Lal è stato dimostrato come nell’arco di una media di 12 settimane tutti i pazienti sottoposti a iniezione di BMA nel focolaio del ritardo di consolidazione abbiano avuto un buon risultato nella consolidazione della frattura. Il minor tempo di consolidamento è avvenuto nell’arco di 8 settimane (Purita et al. 2020). Lo stesso principio viene utilizzato per il trattamento delle pseudoartrosi, dopo la pulizia e preparazione del focolaio e, se necessario, la nuova sintesi per la stabilizzazione.
La triade O’Donoughe è un tipo di lesione estremamente debilitante che coinvolge i legamenti crociato anteriore e collaterale mediale e il menisco mediale. L’approccio chirurgico è il più diffuso ma il recupero totale non è scontato. Recentemente l’approccio ortobiologico con BMA ha dato risultati incoraggianti per aumentare le possibilità di recupero anche in assenza di intervento e in caso di intervento, migliorarne l’esito (Lana et al. 2022).
Per quanto riguarda le necrosi avascolari della testa del femore si è osservato un aumento del midollo grasso nell’area intertrocanterica, il che si traduce in una riduzione del pool di cellule progenitrici dell’osso e quindi una ridotta capacità di rigenerazione della porzione necrotica. La sola core decompression non è sufficiente a causa del ridotto numero di cellule progenitrici presenti nella testa del femore del paziente. Utilizzare il BMA in aggiunta alla core decompression e alla sostituzione dell’osso necrotico con quello vitale si è dimostrata la tecnica con i migliori risultati (Hernigou et al. 2005).
RISULTATI
Nel trattamento dell’OA di anca è stato visto che le MSCs presenti nel BMA, oltre ad un effetto paracrino hanno un’azione immunomodulatoria e antinfiammatoria, riducendo il dolore e migliorando la funzionalità articolare (Zaffagnini et al. 2022; Day et al. 2023). Grazie a questo meccanismo di azione le terapie cellulari sono in grado di portano ad una regressione della degenerazione cartilaginea in presenza di patologia artrosica. Questo favorisce la loro applicazione per il trattamento dell’OA lieve di anca con ottimi risultati mantenuti fino a 24 mesi (Day et al. 2023). Inoltre, il trattamento in generale della patologia artrosica con BMA autologo ha dimostrato un basso rischio di eventi avversi e recenti metanalisi dimostrano risultati molto promettenti, soprattutto riguardo la riduzione della sintomatologia dolorosa e dell’incremento della mobilità articolare a 12 mesi (Kuebler et al. 2022; Pintore et al. 2023). In particolare, è stato osservato che vi sono numerosi vantaggi nell’utilizzo di BMA rispetto ad altre preparazioni con midollo osseo, tra i quali: un unico accesso per il prelievo, prelievo di volumi minimi che si traduce in morbilità ridotta del sito donatore, una procedura più rapida e più sicura senza centrifugazione e quindi riducendo gli step di lavorazione, aspirato ricco di cellule e piastrine senza diluizione con sangue periferico (Kuebler et al. 2022; Pintore et al. 2023). Viganò et al. (2022) hanno valutato i pazienti dopo il trattamento con iniezione di BMA intrarticolare e subcondrale mediante i parametri IKDC, KOOS, e VAS a 6, 12 e 24 mesi. L’indice IKCD è migliorato significativamente in tutti e 3 i follow-up. Anche la VAS è migliorata sensibilmente a 6 mesi per poi mantenersi stabile fino a 24 mesi. È stato osservato un trend positivo anche per i valori KOOS, che migliorano significativamente a 6 mesi per poi mantenersi stabili fino a 24 mesi. Anche Silva et al. (2022) valutano il follow-up mediante la scala WOMAC a 12 mesi e a 24 mesi mediante un test autocondotto. Il punteggio WOMAC a 12 mesi indica un notevole miglioramento nella mobilità articolare, nella debolezza e nel dolore.
Il BMA per il trattamento di ritardi di consolidamento o pseudoartrosi atrofiche è risultato essere un trattamento sicuro ed efficace che riduce i tempi di ricovero del paziente, non preclude riabilitazione e fisioterapia post-operatoria e aumenta il successo nella riparazione della frattura. Inoltre, non causa la formazione di edemi midollari né infezioni. La morbilità del sito è minima e ben tollerata dai pazienti (Hernigou et al. 2005; Haeusner et al. 2023).
CONCLUSIONI
Negli ultimi anni l’interesse per la medicina rigenerativa e l’ortobiologia, soprattutto per quanto riguarda l’utilizzo autologo di midollo osseo aspirato, è decisamente cresciuta grazie agli ottimi risultati ottenuti nei vari studi. Le patologie trattate con i risultati migliori riguardano: OA, edema midollare subcondrale, ritardi di consolidamento e pseudoartrosi (Woodell- May et al. 2021; Kuebler et al. 2022; Pintore et al. 2023; Haeusner et al. 2023).
L’ortobiologia e in particolare il BMA autologo sono procedure a carattere conservativo e minima morbilità che mirano a: ridurre i tempi di ospedalizzazione e quindi di guarigione, mantenere una minima morbilità del sito donatore e migliorare la qualità della vita nel medio/lungo periodo nel trattamento di patologie degenerative come l’OA.
La letteratura fino ad ora analizzata concorda nell’affermare che l’utilizzo di BMA sia una soluzione sicura, semplice, rapida, a bassa morbilità ed efficace per il trattamento autologo e conservativo di patologie a carico del sistema muscoloscheletrico come OA, edema midollare subcondrale, ritardi di consolidamento e pseudoartrosi.
RECOVERYCELL si posiziona nel panorama dei kit dedicati al trattamento di queste patologie nell’ambito della medicina rigenerativa e dell’ortobiologia. RECOVERYCELL coniuga, in un sistema sicuro, semplice e rapido, la ridotta morbilità del sito donatore e la capacità di effettuare un prelievo di BMA ricco di cellule nucleate e piastrine con ottimi risultati nel trattamento delle varie patologie in cui è indicato il suo utilizzo. RECOVERYCELL, grazie al trocar brevettato, massimizza la capacità di raccolta cellulare minimizzandone la diluizione con il sangue periferico, senza bisogno di lavorazioni e/o processazioni.
Redazione scientifica: Dott.ssa Carlotta Boschian.
BIBLIOGRAFIA
- Kon, E., Berruto, M., Condello, V., Peretti, G. M., & Ronga, M. A. R. I. O. (2012). Cartilagine: Istruzioni per l’uso.
- Ibrahim, M., Kartus, J. T., Steigen, S. E., Olsen, R., & Meknas, K. (2019). More tendon degeneration in patients with shoulder osteoarthritis. Knee Surgery, Sports Traumatology, Arthroscopy, 27(1), 267-275.
- Weber, A. E., Bolia, I. K., & Trasolini, N. A. (2020). Biological strategies for osteoarthritis: from early diagnosis to treatment. International Orthopaedics, 1-10.
- Mienaltowski, M. J., & Birk, D. E. (2014). Structure, physiology, and biochemistry of collagens. In Progress in heritable soft connective tissue diseases (pp. 5-29). Springer, Dordrecht.
- Thorpe, C. T., & Screen, H. R. (2016). Tendon structure and composition. In Metabolic influences on risk for tendon disorders (pp. 3-10). Springer, Cham.
- Weinreb, J. H., Sheth, C., Apostolakos, J., McCarthy, M. B., Barden, B., Cote, M. P., & Mazzocca, A. D. (2014). Tendon structure, disease, and imaging. Muscles, ligaments and tendons journal, 4(1), 66.
- Honvo, G., Lengelé, L., Charles, A., Reginster, J. Y., & Bruyère, O. (2020). Role of Collagen Derivatives in Osteoarthritis and Cartilage Repair: A Systematic Scoping Review With Evidence Mapping. Rheumatology and Therapy, 1-38.
- Kumar, S., Sugihara, F., Suzuki, K., Inoue, N., & Venkateswarathirukumara, S. (2015). A double‐blind, placebo‐controlled, randomised, clinical study on the effectiveness of collagen peptide on osteoarthritis. Journal of the Science of Food and Agriculture, 95(4), 702-707.
- Volpi, P., Zini, R., Erschbaumer, F., Beggio, M., Busilacchi, A., & Carimati, G. (2020). Effectiveness of a novel hydrolyzed collagen formulation in treating patients with symptomatic knee osteoarthritis: a multicentric retrospective clinical study. International Orthopaedics.
- De Luca, P., Colombini, A., Carimati, G., Beggio, M., de Girolamo, L., & Volpi, P. (2019). Intra-Articular Injection of Hydrolyzed Collagen to Treat Symptoms of Knee Osteoarthritis. A Functional In Vitro Investigation and a Pilot Retrospective Clinical Study. Journal of clinical medicine, 8(7), 975.
- Martin Martin LS, Massafra U, Bizzi E, Migliore A (2016) A double blind randomized active-controlled clinical trial on the intraarticular use of Md-Knee versus sodium hyaluronate in patients with knee osteoarthritis (“Joint”). BMC Musculoskelet Disord 17: 94. https://doi.org/10.1186/s12891-016-0948-4.
- Furuzawa-Carballeda J, Lima G, Llorente L, Nuñez-Álvarez C, Ruiz-Ordaz BH, Echevarría-Zuno S, Hernández-Cuevas V (2012) Polymerized-type I collagen downregulates inflammation and improves clinical outcomes in patients with symptomatic knee osteoarthritis following arthroscopic lavage: a randomized, double-blind, and placebo-controlled clinical trial. ScientificWorld Journal 2012: 342854. https://doi.org/10.1100/2012/342854.
- Jiang, J. X., Yu, S., Huang, Q. R., Zhang, X. L., Zhang, C. Q., Zhou, J. L., & Prawitt, J. (2014). Collagen peptides improve knee osteoarthritis in elderly women: A 6-month randomized, double-blind, placebo-controlled study. Agro Food Industry Hi Tech, 25(2), 19-23.
- Oláh T., Kamarul T., Madry H., Murali M.R. (2020) The Illustrative Anatomy and the Histology of the Healthy Hyaline Cartilage. In: Goyal D.R. (eds) The Illustrative Book of Cartilage Repair. Springer, Cham. https://doi.org/10.1007/978-3-030-47154-5_2
- Czajka, A., Kania, E. M., Genovese, L., Corbo, A., Merone, G., Luci, C., & Sibilla, S. (2018). Daily oral supplementation with collagen peptides combined with vitamins and other bioactive compounds improves skin elasticity and has a beneficial effect on joint and general wellbeing. Nutrition Research, 57, 97-108.
- García-Coronado, J. M., Martínez-Olvera, L., Elizondo-Omaña, R. E., Acosta-Olivo, C. A., Vilchez-Cavazos, F., Simental-Mendía, L. E., & Simental-Mendía, M. (2019). Effect of collagen supplementation on osteoarthritis symptoms: A meta-analysis of randomized placebo-controlled trials. International Orthopaedics, 43(3), 531-538.
- Yamamoto, S., Deguchi, K., Onuma, M., Numata, N., & Sakai, Y. (2016). Absorption and urinary excretion of peptides after collagen tripeptide ingestion in humans. Biological and Pharmaceutical Bulletin, 39(3), 428-434.
- Porfírio, E., & Fanaro, G. B. (2016). Collagen supplementation as a complementary therapy for the prevention and treatment of osteoporosis and osteoarthritis: a systematic review. Revista Brasileira de Geriatria e Gerontologia, 19(1), 153-164.
- Kohn, M. D., Sassoon, A. A., & Fernando, N. D. (2016). Classifications in brief: Kellgren-Lawrence classification of osteoarthritis. Clinical Orthopaedics and Related Research®, 474(8), 1886-1893.
- Luyten, F. P., Denti, M., Filardo, G., Kon, E., & Engebretsen, L. (2012). Definition and classification of early osteoarthritis of the knee. Knee Surgery, Sports Traumatology, Arthroscopy, 20(3), 401-406.
- Raina, P., & Kalia, R. B. (2018). Osteoarthrosis knee: Need for a simplified prognostic knee score. Journal of Arthroscopy and Joint Surgery, 5(1), 33-41.
- León-López, A., Morales-Peñaloza, A., Martínez-Juárez, VM, Vargas-Torres, A., Zeugolis, DI e Aguirre-Álvarez, G. (2019). Collagene idrolizzato: fonti e applicazioni. Molecole , 24 (22), 4031.